二類體外診斷試劑注冊證許可事項變更
1.抗原、抗體等主要材料供應商變更的;
2.檢測條件、陽性判斷值或者參考區間變更的;
3.注冊產品技術要求中所設定的項目、指標、試驗方法變更的;
4.包裝規格、適用機型變更的;
- 立即咨詢
-
全國服務熱線:
400-888-7587

400-888-7587
? 辦理條件 / Conditions
(一)申請體外診斷試劑注冊證書許可事項變更的申請人,應符合以下條件之一:
1.抗原、抗體等主要材料供應商變更的;
2.檢測條件、陽性判斷值或者參考區間變更的;
3.注冊產品技術要求中所設定的項目、指標、試驗方法變更的;
4.包裝規格、適用機型變更的;
5.產品儲存條件或者產品有效期變更的;
6.增加預期用途,如增加臨床適應癥、增加臨床測定用樣本類型的;
7.可能影響產品安全性、有效性的其他變更。
(二)有以下情形之一的,不予申請:
1.產品基本反應原理改變;
2.產品陽性判斷值或者參考區間改變,并具有新的臨床診斷意義;
3.其他影響產品性能的重大改變。
(三)廣東省藥品監督管理局發放醫療器械注冊證書(體外診斷試劑),證書在有效期內。
政府官方原文鏈接:
https://www.gdzwfw.gov.cn/portal/guide/11440000MB2D034421244017201500404
? 申請材料清單 / List of application materials
1.體外診斷試劑注冊變更申請表 2.證明性文件 3.注冊人關于變更情況的聲明 | 4.原醫療器械注冊證及其附件復印件、歷次醫療器械注冊變更文件復印件 5.具體變更情況的技術資料要求 6.符合性聲明 |
? 辦理流程 / Processing process
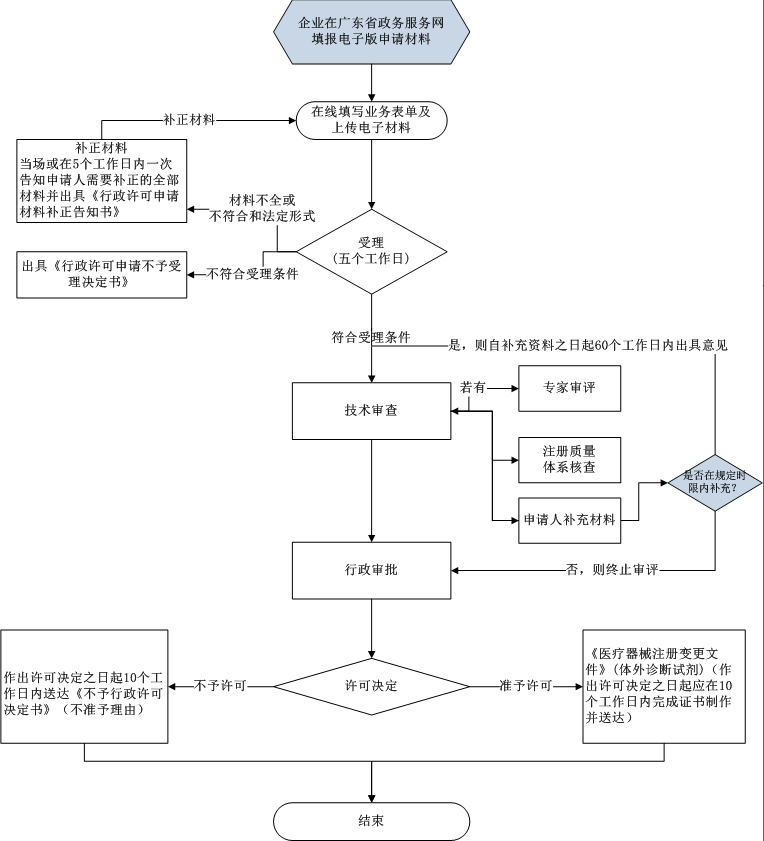
? 特殊環節依據 / Special link basis
名稱 | 其他審查方式 | 時限 |
承諾辦結時限 | 技術審評結束后8個工作日內做出決定。 | 8(工作日) |
法定辦結實現 | 技術審評結束后20個工作日內做出決定。 | 20(工作日) |
到現場次數 | 0次 |
? 辦理依據 / Processing basis
1. 法律法規名稱:《醫療器械監督管理條例》 依據文號:2017年國務院令第680號修訂第十一條、第十四條 | 2. 法律法規名稱:《體外診斷試劑注冊管理辦法》 依據文號:2014年國家食品藥品監督管理總局令第5號 第六條、第五十八條、第六十一條 |
? 金飛鷹相關服務 / Golden Eagle related services
●許可事項變更確認 ●注冊證許可事項變更資料準備 ●注冊證許可事項變更遞交 ●注冊證許可事項變更進度跟蹤
全面解決您的研發、生產、驗收、營銷全流程問題

practical experience
2000多個二、三類醫械項目經驗沉淀,為你分配做過相同案例的實戰老師。
Professional translation
匯聚7大語種專業翻譯精英,多年醫械行業翻譯經驗,能準確翻譯專業名詞及用語。
Software development
強大的軟件研發團隊,已為集團研發出成熟的項目管理軟件,可提供軟件定制服務。
Group supply chain
嚴選數十個優秀的醫械行業服務機構,可為客戶推薦更實惠的醫械配套服務。
多次創造二三類高風險產品一次性通過的行業紀錄
項目狀態:已結案
項目輔導老師:李老師
項目狀態:已結案
項目輔導老師:車老師
項目狀態:已結案
項目輔導老師:王老師
項目狀態:已結案
項目輔導老師:黃老師