醫療器械的生物學評價是確保醫療器械安全、有效并減少對人體健康潛在風險的關鍵環節。通過生物學評價,可以全面評估醫療器械與人體之間的相互作用,包括材料的生物相容性、醫療器械的安全性和有效性等。本期文章我們轉載了北京市藥監局匯總的醫療器械生物學評價標準及相關共性問題,以供相關企業在產品研制階段參考。
不同類型醫療器械的
生物學評價標準
GB/T 16886系列標準規定了醫療器械生物學評價的一般要求和方法,包含風險管理過程中的評價與試驗、動物福利要求、遺傳毒性、致癌性和生殖毒性試驗等,適用于廣泛的醫療器械生物學評價,旨在保證醫療器械的安全性和有效性。
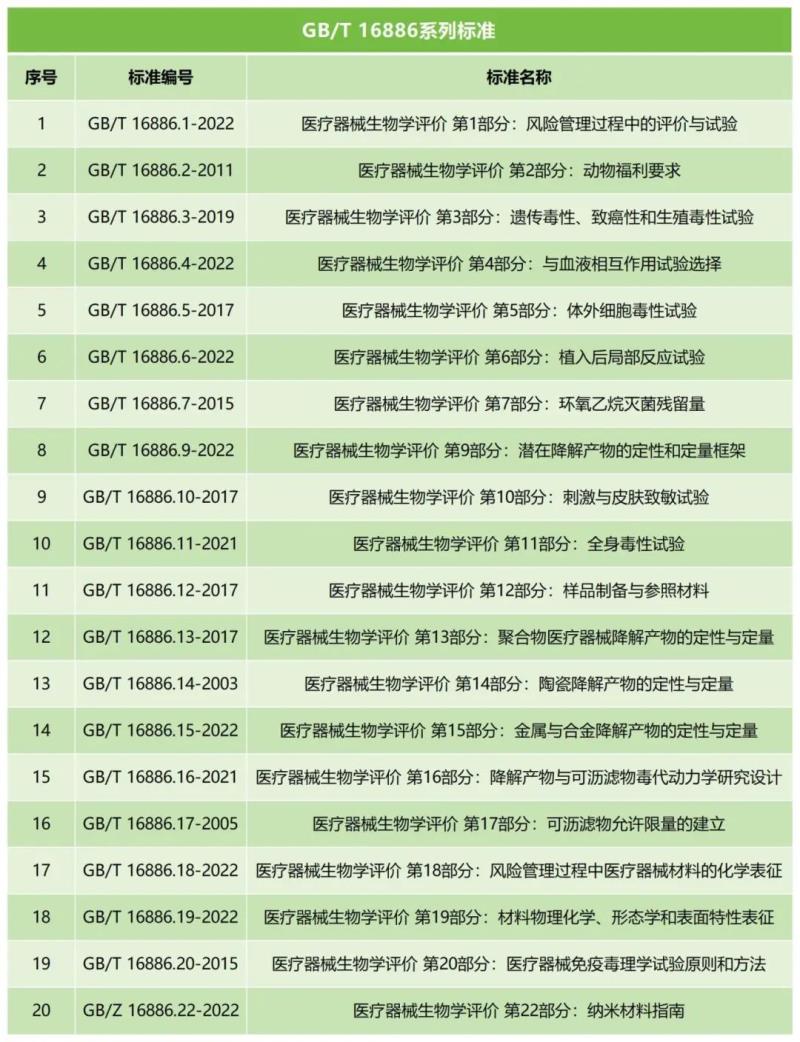
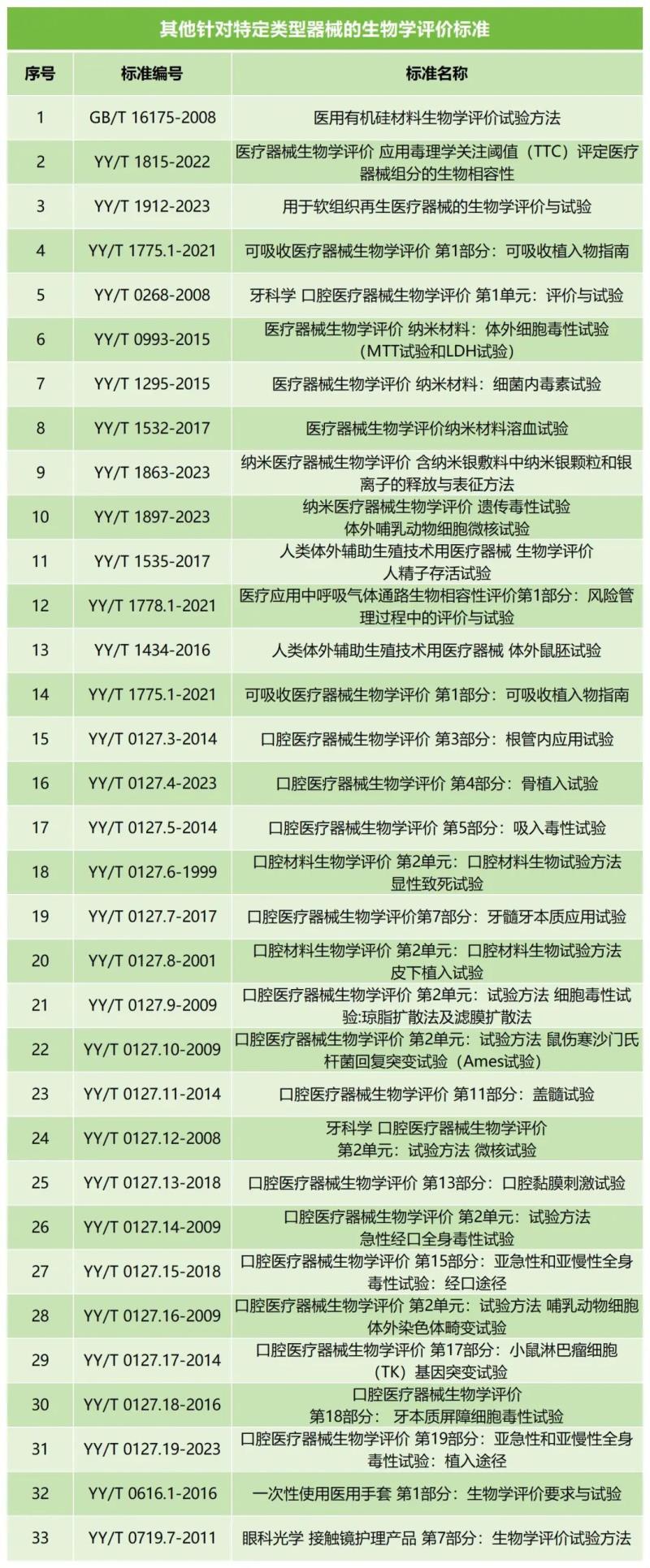
對于某些特定類型的醫療器械,可能需要遵循更具有針對性的評價標準,例如,牙科器械應考慮YY/T 0127口腔醫療器械生物學評價,該標準涵蓋了牙科用醫療器械的生物學評價各個方面,包括根管內應用試驗、吸入毒性試驗、骨植入試驗等。
當利用已上市同類器械的生物學試驗數據 進行生物學評價時 哪些因素可能影響生物相容性風險? 答:(1)影響生物相容性風險的主要因素有:產品的材料化學組成(包括各組成材料比例)、產品物理結構、表面特性、生產工藝、滅菌方法、原材料供應商及技術規范、液體類產品/濕態保存類產品還需考慮內包裝材料。 (2)若受試品與申報產品在以上所列可能影響生物相容性風險的因素中存在不一致的情況,則需提供充分的理由和證據支持所提交的試驗報告適用于申報產品,必要時補充相應的生物學評價資料,如可瀝濾物分析及毒理學風險評定資料、相關生物學試驗項目的補充試驗等。 當使用本企業已上市同類器械的 生物學試驗報告 替代申報產品的生物學試驗報告時 需要進行哪些考量? 答:(1) 申請人需確認試驗報告中的受試同類產品與申報產品在材料化學組成、各組成材料比例、產品物理結構、表面特性、生產工藝、滅菌方法、原材料供應商及技術規范、內包裝材料(如適用,主要涉及液體類產品、濕態保存產品)等任何可能影響生物相容性風險的因素均完全一致,并提供相關聲明。 (2)若受試品與申報產品在以上所列可能影響生物相容性風險的因素中存在不一致的情況,則需提供充分的理由和證據支持所提交的試驗報告適用于申報產品,必要時補充相應的生物學評價資料,如可瀝濾物分析及毒理學風險評定資料、相關生物學試驗項目的補充試驗等。 (3)同類產品的生物學試驗報告僅用于替代申報產品試驗報告作為生物學評價的一部分,而不是替代申報產品的整體生物學評價報告。 是否可以采用與終產品相同的原材料 進行生物相容性試驗? 答:生物學評價應考慮產品制造所用材料、預期的添加劑、工藝污染物和殘留物、可濾瀝物質、降解產物、最終產品的物理特性、各個組件及他們在最終產品中的相互作用、包裝材料和保存介質對生物相容性的影響等因素,因此產品的生物相容性試驗原則上應采用終產品進行,或采用取自最終產品上有代表性的樣品。如采用終產品進行試驗不可行,可考慮采用與終產品以相同的工藝過程制得的試樣進行試驗,但需對試樣的代表性進行充分的分析論證。 另外,當一個器械上有不同的組成材料時,在選擇試驗樣品時應考慮不同成分間可能存在的化學反應,以及不同成分對人體的綜合作用。但若醫療器械不同組件與人體接觸性質和接觸時間不同,應考慮分別進行生物學試驗。 生物學評價亞慢性毒性試驗報告 常見需注意問題有哪些? 答:對于試驗中出現統計學差異的評價指標,試驗報告需明確相關差異是否有生物學意義并提供理由、分析判斷相關差異與受試產品的關系,而非僅簡單列出具有統計學差異的項目。另外,對于通過植入方式接觸受試品的亞慢性毒性試驗,需提供植入劑量的確定依據,如,在動物可耐受情況下,推薦樣本植入劑量為擬用人體臨床劑量的50~100倍。 國外實驗室出具的生物相容性試驗報告 在中國注冊時是否認可? 答:國外實驗室出具的生物學試驗報告,應附有國外實驗室表明其符合GLP實驗室要求的質量保證文件。若滿足相關技術要求(如GB/T 16886/ISO 10993系列標準),則可以作為支持醫療器械生物學評價的生物學試驗資料提交。 熱原與細菌內毒素是否等同? 答:熱原泛指能引起機體發熱的物質,熱原包含了材料致熱及細菌內毒素致熱兩方面信息,屬于生物學評價項目。細菌內毒素是革蘭氏陰性菌死亡、自溶后,釋放出的細胞壁中脂多糖成分,通常來源于生產中引入的生物污染,不屬于生物學評價項目。一般來說,細菌內毒素是熱原,但熱原不全是細菌內毒素。
醫療器械注冊咨詢認準金飛鷹 深圳:0755-86194173 廣州:020 - 82177679 四川:028 - 68214295 湖南:0731-22881823 湖北:181-3873-5940 江蘇:135-5494-7827 廣西:188-2288-8311 海南:135-3810-3052