本文轉自中國醫藥報,作者:周瀅 張咪 高文杰
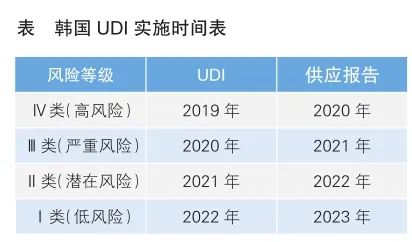
隨著智能化技術的蓬勃發展,醫療器械領域的通用語言——醫療器械唯一標識(UDI)已在醫療器械全生命周期監管中扮演了舉足輕重的角色。全球實施統一UDI路徑將有助于醫療器械產品在供應鏈中的精準識別、產品追溯、召回等。為此,國際醫療器械監管機構論壇(IMDRF)、全球醫療器械法規協調會(GHWP,其前身為亞洲醫療器械法規協調會AHWP)等國際組織紛紛對UDI系統開展研究并推動實施。 2011年9月,全球醫療器械協調工作組(GHTF,IMDRF前身)發布了《醫療器械唯一標識(UDI)系統指南》,強調任何國家和地區的醫療器械監管機構建立UDI系統時應遵循一致的基本概念,以最終達到真正的全球UDI框架。 IMDRF于2012年成立UDI工作組,并于次年12月9日發布了《UDI指南:醫療器械唯一標識》(以下簡稱《UDI指南》),為全球UDI系統建設提供了一個應該如何工作的高級概念視圖。2019年3月21日,IMDRF通過了《唯一標識系統(UDI系統)應用指南》,主要圍繞應用層面提供相關指導。 2019年11月14日,AHWP發布UDI白皮書,與IMDRF發布的《UDI指南》觀點基本一致,同時也列出了UDI在實施過程中遇到的挑戰,并提出應對建議方法。 自2013年以來,全球許多國家和地區在實施UDI系統方面取得了重要進展。 美國于2007年和2012年分別發布了《FDA補充法案》和《FDA安全和創新法案》,為美國食品藥品管理局(FDA)實施UDI確立了法規基礎。2013年9月,FDA發布《UDI最終規則》,計劃通過7年時間,分階段、按計劃實施UDI。2014—2016年,FDA陸續發布一系列指南文件,包括UDI數據庫填報、關鍵性技術以及特殊類型產品等核心內容。FDA并不是將UDI所有指南與法規同時發布,而是將相關指南與各產品的合規日期相結合,逐步發布。 目前,FDA認可的發碼機構包括國際物品編碼組織(GS1)、衛生行業商業交流委員會(HIBCC)和國際血庫自動化委員會(ICCBBA)。FDA在《UDI最終規則》中保留在極端情況下或者FDA認為必要時,FDA作為發碼機構的可能性。此外,FDA對發碼機構采取的是認可方式,期限為3年,到期后可申請更新,但FDA有權撤銷認可。 FDA在2013年引入UDI系統。2013年9月,美國UDI數據庫(GUDID)正式啟用;2014年6月,發布UDI數據庫指南;2015年5月,發布GUDID公眾數據平臺,可供公眾免費查詢、數據下載等。美國法規要求UDI數據信息必須提交GUDID。2020年7月,UDI指南增加關于成品設備的直接標記要求。2022年7月,FDA發布有關I類產品和非分類設備合規日期、直接標記以及某些設備的全球唯一標識數據庫要求等政策。目前,美國Ⅱ、Ⅲ類醫療器械產品已全部實施UDI,但暫不要求Ⅰ類和未分類產品實施UDI[植入式、維持生命或支持生命(I/LS/LS)設備外]。 2017年5月,歐盟發布了醫療器械法規(MDR)和體外診斷醫療器械法規(IVDR),設立UDI專章,規定歐洲醫療器械數據庫(EUDAMED)相關建設內容。 MDR明確,歐盟委員會應通過實施細則來指定或由多個發碼機構根據法規規定操作UDI分配系統。2019年6月,歐盟委員會發布(EU)2019/939號實施公告,認定GS1、HIBCC、ICCBBA和德國醫藥產業信息中心(IFAGmbH)為UDI系統發碼機構。 根據MDR和IVDR,歐盟委員會計劃分階段逐步實施UDI,具體如下: ? Ⅲ類器械和可植入器械,自2021年5月26日起適用。可植入器械包括部分Ⅱa類器械(如種植牙)、Ⅱb類器械或Ⅲ類器械。 ? Ⅱa類、Ⅱb類器械和D類診斷器械,自2023年5月26日起適用。 ? Ⅰ類器械、B類和C類體外診斷器械,自2025年5月26日起適用。 ? A類體外診斷器械,自2027年5月26日適用。 ? 本體標識產品自相應分類器械標簽適用時限起的兩年內實施完成。對于已上市產品。在符合MDR/IVDR時,也應符合UDI要求。 EUDAMED是提交和存儲UDI信息的數據庫,計劃在2025年第二季度開放使用。此前如有產品相關的重大安全事件發生,將提早要求數據錄入系統。目前已經開放用戶注冊功能。 日本厚生勞動省自2002年起,每年會對醫療器械等信息化進展情況進行調查。2008年3月《關于對醫療器械等的條形碼顯示實施的通知》發布,旨在提高物流和醫保結算效率,減少醫療事故。該通知只作為推薦事項來實施,不作為法律義務。 隨著修訂后的《藥品與醫療器械法》于2021年8月1日實施,日本醫療器械產品的說明書全面電子化,并在醫藥品醫療器械綜合機構(PMDA)網站上發布,醫院等可使用應用程序APP讀取包裝上的條形碼,查看產品說明書。由此提出了醫療器械包裝的UDI標簽要求并于2022年12月起生效,要求根據器械類型逐步實施,醫療器械的即時容器、包裝材料、零售包裝應使用基于國際標準的條形碼標簽。日本UDI基本采用GS1-128碼作為醫療器械條碼要求。 2017年,韓國食品和藥品安全部(MFDS)推出UDI系統實施計劃。2018年12月21日,MFDS發布UDI規則,提出將建立UDI信息數據庫(IMDIS),按照產品風險等級分步實施UDI。同時,為滿足產品可追溯性,MFDS也將建立UDI供應報告。2019年6月,UDI數據庫(IMDIS)建成,由國家醫療器械安全信息研究所(NIDS)管理。2019年10月,NIDS發布UDI指南,與IMDRF框架一致。UDI實施計劃如表所示。
美國、歐盟、日本和韓國在UDI法規和實施方面各具特色。
美國是UDI實施的先行者,其UDI法規和系統相對成熟完善。FDA通過發布《UDI最終規則》及相關指南,持續指導各方合規實施,使醫療設備安全性和監管效率得到有效提升。歐盟單獨設立UDI法規章節,詳細規定編碼、存儲、交換和數據庫建設等要求,實施著眼于對接國際標準,為國際信息共享與合作提供便利。日本UDI法規從實際應用效果出發,把UDI運用到醫療信息化系統,對醫療信息化和追溯使用的發展起到了積極作用。韓國實施UDI起步雖晚但進展迅速,強調追溯和監管,逐步推進從生產到使用的全過程監管。
從各國的實施經驗來看,UDI的實施是一個長期的、系統性的工程,應充分考慮產品的多樣性和復雜性,適時調整執行策略。雖然不同國家和地區的UDI法規存在差異,國際協調存在挑戰,但UDI在提升醫療器械安全性和可追溯性、降低醫療事故風險、優化患者護理等方面的優勢正逐漸體現。
美國自發布器械產品分類實施時間表后,經歷數次延期,尤其低風險和未分類醫療器械經歷3次延期后才最終確定實施日期。因此,積極借鑒國際標準,分步實施UDI顯得尤為重要。我國分別于2021年1月、2022年6月和2024年6月對醫療器械產品分步實施UDI,在給予企業一定過渡時間的同時,充分體現了政府引導、企業落實、統籌推進的工作機制。
醫療器械注冊咨詢認準金飛鷹 深圳:0755-86194173 廣州:020 - 82177679 四川:028 - 68214295 湖南:0731-22881823 湖北:181-3873-5940 江蘇:135-5494-7827 廣西:188-2288-8311 海南:135-3810-3052